科学家揭示TET2形成生物大分子聚集体的分子基础
2024年9月9 日,美国德州农工大学黄韵教授、李佳教授和周育斌教授课题组合作在《自然—细胞生物学》(Nature Cell Biology)杂志上发表了题为“Perturbation of TET2 condensation promotes genome-wide promiscuous DNA hypomethylation to curtail leukemia cell growth”的最新研究。
该论文深入探讨了TET2酶在调控DNA去甲基化和基因转录中的独特机制,并为其临床治疗应用提供了新的可能性。德州农工大学的郭磊助理教授和洪婷婷博士为该论文的共同第一作者。
TET2作为一种关键的DNA去甲基化酶,在细胞分裂和谱系分化过程中,能够在基因组的特定区域进行精准的去甲基化。在血液系统中,TET2基因的突变是最常见的致病原因之一,其功能丧失通常导致DNA去甲基化的紊乱,引发基因表达异常,最终推动白血病及骨髓增生异常综合症(MDS)的发生。TET酶的主要产物5-羟甲基胞嘧啶(5hmC)在组织特异性的基因组区域(如增强子)高度富集,但其选择性调控机制尚未被完全阐明。
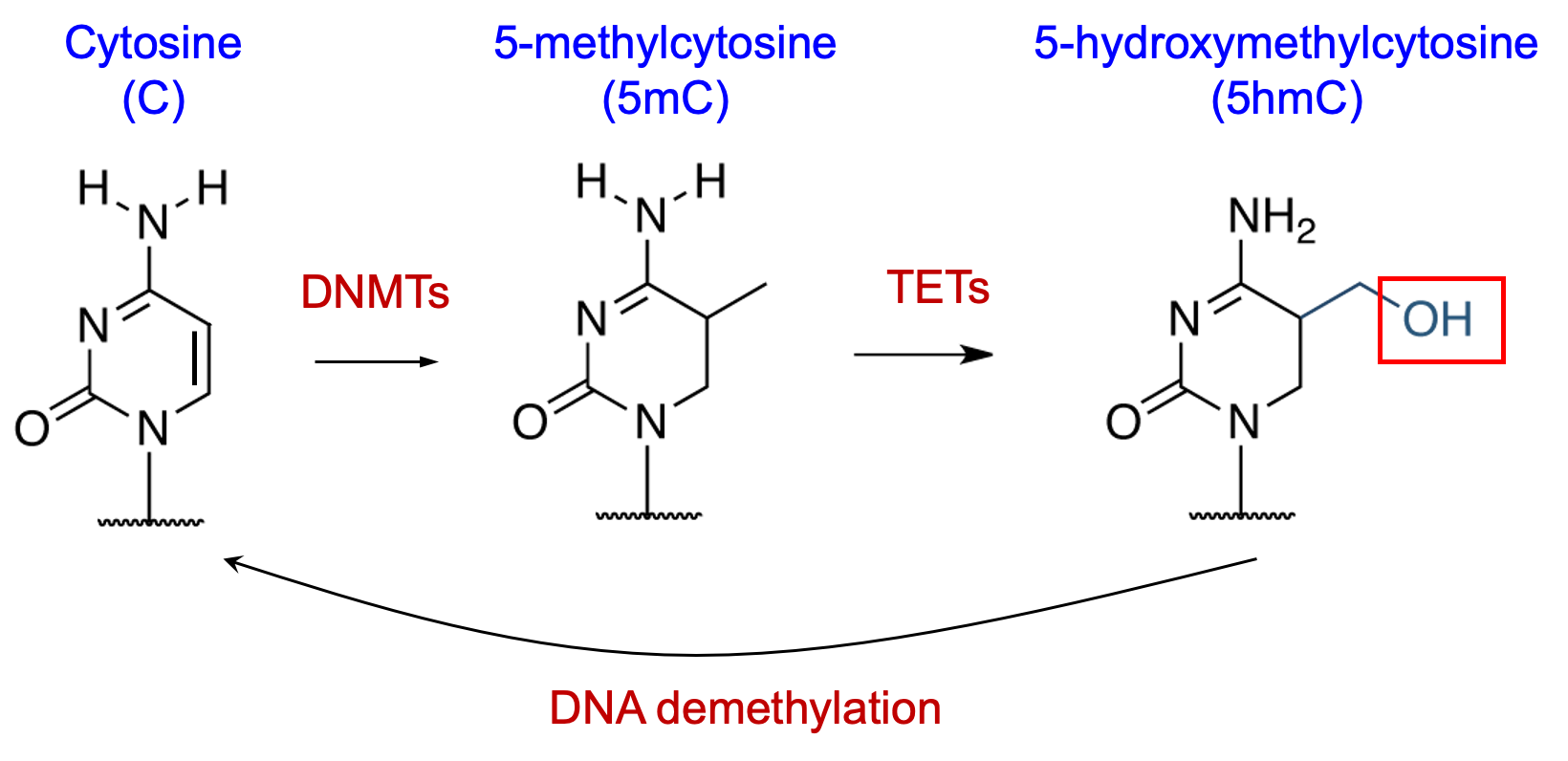
图1: DNA甲基化和去甲计划的过程。
液-液相分离(LLPS)是指细胞内大分子通过弱而可逆的相互作用形成高度动态的液滴状结构。这些液滴通过与周围环境的不同分子组成和物理性质隔离开来,形成局部浓缩的反应环境。液-液相分离在生物学中具有重要意义,因为它可以调控细胞内许多关键过程,包括信号传导、转录调控、RNA加工、蛋白质聚集等。
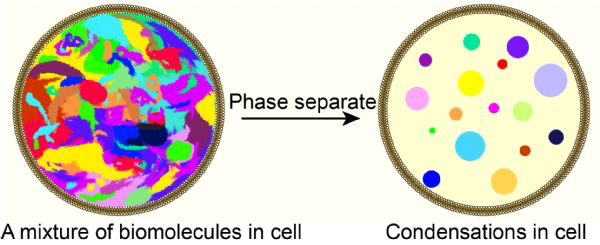
图2: 细胞内生物大分子液-液相分离(LLPS)模式图。
该研究表明,TET2具有一种先前未被认知的液态凝聚(liquid condensation)特性,这一特性帮助其在增强子区域进行精准的基因组定位,并维持DNA去甲基化的稳定性。通过结构生物学分析,研究团队在TET2催化域中发现了一个低复杂度插入区(low complexity insert, LCI),这一无序蛋白序列推动TET2形成大分子凝聚体,并进一步促进与UTX和MLL4等表观遗传调控因子的共凝聚,确保其在特定染色质区域的结合。突变分析显示,LCI具有朊状结构域(PLDs),其中芳香残基的排列决定了TET2的凝聚行为。有趣的是,破坏TET2凝聚的形成虽然对其催化功能影响甚微,但显著影响了其DNA去甲基化的精确性,导致全基因组范围内不受控的DNA去甲基化。这一发现与以往研究的结论不同,表明凝聚体的破坏并不总意味着蛋白功能的丧失,反而可能增强去甲基化活性。
通过在白血病细胞和基因改造的小鼠模型中的实验,研究发现干扰TET2凝聚体的形成会改变TET2在基因组中的结合,导致异常的DNA去甲基化和基因表达,最终有效抑制白血病细胞的增殖和疾病进展。这一干预对快速扩增的癌细胞表现出选择性杀伤效果,而对正常细胞影响甚微。

图3:TET2通过LCI结构域形成液态凝聚体,并和增强子相关蛋白(UTX,MLL4)形成共凝聚体,从而确保其精确的基因组定位(如增强子区域)和特定位置的选择性DNA去甲基化。缺失或破坏LCI结构域的完整性导致TET2无法有效形成液态凝聚体,进而失去准确的基因组定位,从而引发全基因组不受控制的去甲基化,引发癌细胞的死亡。
该研究揭示了破坏TET2凝聚体的形成可以成为血液癌症治疗的新靶点,并为相关的临床治疗方法提供了新的启示。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41556-024-01496-7



